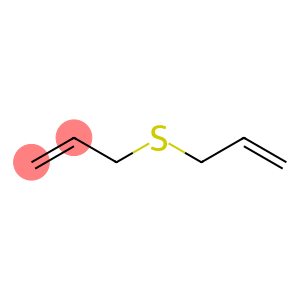
Sulfuro de alilo (CAS#592-88-1)
| Símbolos de peligro | Xi – Irritante |
| Códigos de riesgo | R10 – Inflamable R36/37/38 – Irrita los ojos, las vías respiratorias y la piel. |
| Descripción de seguridad | S26 – En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua y consultar a un médico. S36 – Úsese indumentaria protectora adecuada. S37/39 – Úsense guantes y protección para los ojos y la cara adecuados S23 – No respirar los vapores. S16 – Mantener alejado de fuentes de ignición. |
| identificaciones de la ONU | ONU 1993 3/PG 3 |
| WGK Alemania | 2 |
| RTECS | BC4900000 |
| TSCA | Sí |
| Código HS | 29309070 |
| Clase de peligro | 3 |
| Grupo de embalaje | III |
Introducción
El sulfuro de alilo es un compuesto orgánico. Tiene las siguientes propiedades:
Propiedades físicas: El sulfuro de alilo es un líquido incoloro con un fuerte olor acre.
Propiedades químicas: El sulfuro de alilo es capaz de reaccionar con muchos compuestos, especialmente reactivos con electrofilicidad, como halógenos, ácidos, etc. Puede sufrir reacciones de polimerización en determinadas condiciones.
Principales usos del sulfuro de alilo:
Como intermedio: el sulfuro de alilo se puede utilizar como intermedio en la síntesis orgánica y participar en una serie de reacciones de síntesis orgánica, por ejemplo, se puede utilizar para sintetizar haloolefinas y compuestos heterocíclicos de oxígeno.
Existen varios métodos principales para la preparación de sulfuro de alilo:
Reacción de sustitución de hidrotiol: el sulfuro de alilo se puede formar mediante reacciones como el bromuro de alilo y el hidrosulfuro de sodio.
Reacción de conversión de alcohol alílico: preparado mediante la reacción de alcohol alílico y ácido sulfúrico.
Desde una perspectiva de seguridad, el sulfuro de alilo es una sustancia irritante que puede causar irritación y daños en contacto con la piel y los ojos. Evite el contacto directo con la piel y los ojos durante su uso y mantenga buenas condiciones de ventilación. El sulfuro de alilo es volátil y debe evitarse en caso de exposición prolongada a altas concentraciones de vapores o gases.